一、稀的氢氟酸水溶液是弱酸。
之前以为这是因为氟氢键的键能太强,导致氟化氢难以完全电离。但最新的光谱学证据表明:氟化氢在水溶液中竟然是完全电离的,只不过没有生成水合氢离子 H3O+ 和氟离子 F-,而是生成了牢固的离子对:H3O+F-:
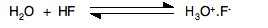
如果要体现出酸性,则需要离子对 H3O+F- 的电离,也就是让水合氢离子不要附着在氟离子上,可惜的是,离子对 H3O+F- 本身很难电离,如下:
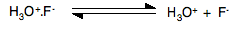
总之,氢氟酸在水溶液中体现为弱酸不是因为氟氢键键能太强导致电离弱,主要是因为形成的离子对 H3O+F- 太牢固。
二、氢氟酸是强酸
之前说氢氟酸是弱酸,现在又说是强酸,岂不是自相矛盾吗?
要看好前面的限定条件哦:“在水里的稀溶液”,也就是用 pH 去衡量酸性。但这里存在一个“拉平效应”:强酸中的强酸在水溶液中无法体现出更强的酸性。比如硫酸和硝酸在水中电离的都相当彻底,无法分辨谁更强。而在醋酸作为溶剂时,又可发现几种强酸的酸性明显有高低之分,比如高氯酸>硫酸>硝酸。
这个效应让化学家们意识到,还得考虑溶剂这种介质的影响。1905 年,富兰克林进一步发展了酸碱电离理论,提出了酸碱溶剂理论。另一方面,也促使化学家们思考更好的衡量酸性的标度。
为什么氢氦正离子(HHe+)是宇宙最强酸?
有一种叫做哈米特酸度函数(H0)的度量,专门用于衡量浓缩溶液的酸性。比如浓硫酸,并不是很大程度上电离出氢离子,而是自耦电离出硫酸氢根离子 HSO4- 和硫酸合氢离子 H3SO4+,所以浓硫酸是一种强电解质,导电性很强。用哈米特酸度函数去衡量的话,浓硫酸的 H0 为 -12。
鲁超:【元素家族——连载 105】硫酸——化工水平的标志
在浓溶液或不含水的情况下,氢氟酸可以自耦电离成氟化氢合氟离子 HF2- 和氟化氢合氢离子 H2F+,如下图:
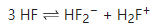
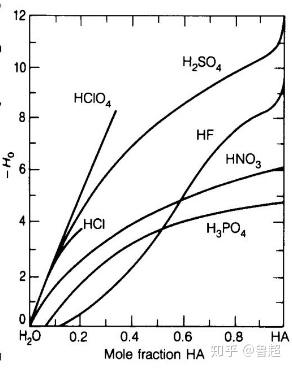
用哈米特酸度函数(H0)去衡量纯酸的话,氢氟酸的 H0 可达到 -15.1,和硫酸的 -12 相比,氢氟酸比硫酸的酸性强一千倍。
下图为不同摩尔分数的 H0 值,可以看出,随着摩尔分数的提高,氢氟酸后来居上,不断超越各种强酸。
参考:
1,https://pubs.acs.org/doi/abs/10.1021/ja01571a016
2,https://macsphere.mcmaster.ca/handle/11375/8664
3,http://www.chemguide.co.uk/inorganic/group7/acidityhx.html
4,Gerrylynn K. Roberts, Colin Archibald Russell.Chemical History: Reviews of the Recent Literature. Royal Society of Chemistry,2005.
5,Superacid chemistry. Olah, George A. (George Andrew), 1927-2017., Olah, George A. (George Andrew), 1927-2017. (2nd ed.). Hoboken, N.J.: Wiley. 2009.

 微信扫一扫
微信扫一扫