准确的说,金属之所以存在导电性,确实就是存在自由电子导致的。
但是,导电性的强弱,并不是由是否容易失去外层电子决定的,也就是说金属的金属性和导电性无关。
本质上,自由电子在外界电场的作用下移动时受到的阻力,宏观体现即为电阻,电阻越高,导电性越差。实际上,不管是金属还是任何其他固体,其晶体的结构,晶格的结构等等一系列因素都会影响导电性。
所以,你要弄清楚的是, 虽然金属的特性是容易失去外层电子,形成自由电子,但是可不是说这些自由电子就真正的『自由』完全没有阻力了。
金属中的自由电子,仍然要受到金属离子(失去价电子后的金属原子)的吸引作用。自由电子和金属离子之间会形成金属键, 实际上是这个金属键的强弱决定了金属的大部分性质。
如果上中学学过晶体的基础知识,那么你脑子里现在可以想象这样一个基础模型,金属离子之间组成晶格,在晶格当中存在一些自由电子,自由电子和金属离子直接形成金属键。
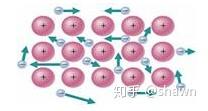
那么,金属键越强,对金属自由电子的束缚力就越强。
剩下的问题就是要弄清楚, 是什么影响到金属键的强弱:
首先,第一个规律是, 原子序数越大,最外层电子离原子核就越远,从而导致金属离子对『自由电子』的束缚力就越弱,从而是的自由电子阻力越小,导电性越好。
所以,Li , Na 由于金属离子对自由电子的作用力很强,相对导电性就比较差了。
第二个规律是,和金属原子核外电子排布规律有关(想要彻底弄清楚这部分,请先学习核外电子排布的基本规律):
我们可以发现,导电性最强的几种金属,全部分布在 11 族。
为什么这一族的金属导电性那么强? 这是因为这一族的核外电子排布规律是,存在全满的 d 轨道和最外层未满的 s 轨道。我们以铜和银来举例说明:
铜的核外电子排布 :
银的核外电子排布:
我们可以看到,铜,银的最外层都只有 s 轨道的一个电子,而其他轨道全满。尤其是次外层 d 轨道均被电子填满。
这就导致,当银 / 铜的最外层 s 电子变成自由电子后,银 / 铜离子和电子之间形成的金属键完全只依靠最外层的 s 轨道,而次外层 d 轨道已经形成稳定结构,不会对金属键产线影响。 这样就使得金属键对自由电子的束缚力非常弱,从而导电能力变得非常强。
我们可以看一下银附近的金属,
比如,Rh 铑的核外电子排布:
和银相比,虽然同样有易失的最外层 s 电子,由于次外层的 d 轨道只有 8 个电子,所以,铑的金属键很强,对自由电子束缚力大,从而使得导电性能比较差。所以银的电阻率为
,姥的电阻率为
我们在看原子序数比银大 1 的 Cd 镉:
Cd 镉的核外电子排布:
镉的最外层排布了 2 个 s 电子,这样就形成了稳定结构,从而使得,5p, 5d 轨道都有机会束缚自由电子,这样就使得镉的金属键非常强,从而电阻也变得比较大。
第三 相对论效应产生的影响
讲到这,有人肯定就有疑惑了, 那么同为 11 族金属的金,为什么反而导电能力要比铜还差呢?
没错,如果按照上面的规律,理论上金的导电能力要比银还要好,可为什么反而不如铜了呢?
这是因为,电子实际上在核外做高速运动,而原子序数越大,电子的能量越高,速度就越快。
根据相对论我们知道,速度越快,质量就会变得越大,所以当速度超过 50%光速时,电子的高速运动已经开始对核外电子的轨道能量产生影响。
有一个公式可以用来近似的计算核外电子第一轨道的电子相对于光速的速度。
通过计算,79/137=57.6%光速, 这样,金原子的相对论效应就无法忽视了。
由于金原子核外电子以超过一半的光速的速度运动,因为相对论效应明显,质量增加,需要消耗更多的能量,这样就使得金原子核外电子能量整体降低,轨道收缩。使得金离子对自由电子的吸引作用变得更强,而是导致金的电阻实际上要比铜还要高。
金单质具有黄色也是这个原因,相对论效应使得核外电子能级降低,电子跃迁时吸收的光能量变低了,从而使得吸收光谱从紫外区回落到了可见光区,这样就使得金产生了颜色。
掌握了上面三个规律,基本上就弄明白了大多数金属导电性强弱的原因。注意此规律只涉及金属单质,其他金属合金和金属化合物则会更加复杂。
PS: 实际上说金属中存在『自由电子』确实会对人产生误导,更准确的说法应当称之为『离域电子』。

 微信扫一扫
微信扫一扫