自 Kellwasser 事件和 Hangenberg 事件(参见第一百五十六回 星陨,冰封,海退;第一百五十七回 窒息,乱流,终结)造成的萧条中恢复后,海洋生态系统已经维持了超过 1 亿年的繁荣和富饶。在石炭纪到二叠纪期间,泛古大陆愈合成型,同时也把海洋一分为二:一小部分被泛古大陆环抱,形成古特提斯海(Paleo-Tethys Ocean);余下的大部分包围着所有的陆地和岛群,形成泛古洋(Panthalassic Ocean)。
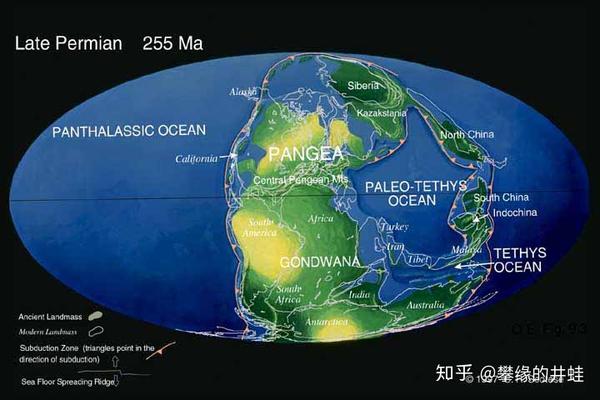
二叠纪晚期地球海陆分布。北方的劳亚古陆(Laurasia)和南方的冈瓦纳古陆(Gondwana)汇聚成“C”字形的泛古大陆。泛古大陆的形成和分裂,是地球进入显生宙以来最漫长最重大的事件之一,它极大影响甚至部分决定了生命的形态结构和演化进程。图片来源自网络。
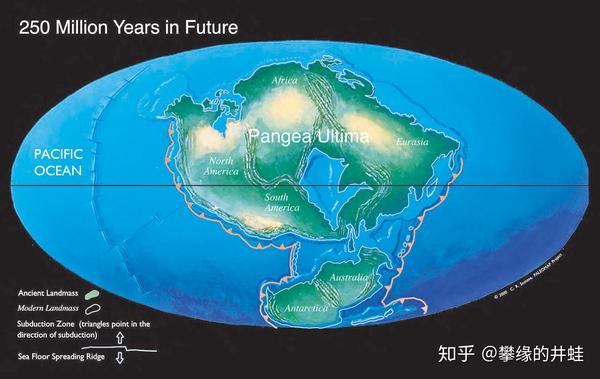
根据板块构造理论推算,大约 1 到 2.5 亿年后,全球陆地很可能再次汇聚在一起。人们给这块未来的超级大陆取了许多名字:终极泛大陆(Pangaea Ultima),比邻泛大陆(Pangaea Proxima),泛新大陆(Neopangaea),或泛大陆二世(Pangaea II)。到时统治这个新世界的将会是一些什么样的生命形态呢?这真是个让人无限遐想的问题。图片来源自网络。
和开阔的泛古洋相比,古特提斯海有着更加得天独厚的环境条件:四面环绕的大陆和岛屿缓冲了风浪,使得水流相对平缓,适宜造礁和附礁生物固着生长。紧邻的陆块向海底延伸,形成了宽阔的浅海架,阳光可以直射海底,加上泛古大陆的江河源源不断地注入氮磷盐类和有机碎屑,各种光合生物充分发育,有机物生产旺盛,为底栖和游泳动物提供了充足的食物和栖身之所。来自赤道的暖流(warm current)和来自极地的寒流(cool current)交汇混合,一面调节了水温,又产生对流,搅动富含营养在海底沉积物,翻到水体上层,滋养着数量庞大的浮游生物,为整个海洋食物网打下坚实的基底,使各个层级的消费者无饥馑之虞,有扩张之资。这片乐土上的各种生物,大的,小的,固着不动的,随波漂流的,游泳的,爬行的,穴居的,吃海草的,过滤海水的,捕食其他动物的,冷水性的,暖水性的,长居海洋的,在淡水和海水间洄游往返的,都可以找到适合的栖息地和繁殖场,安然延续自己的族群。
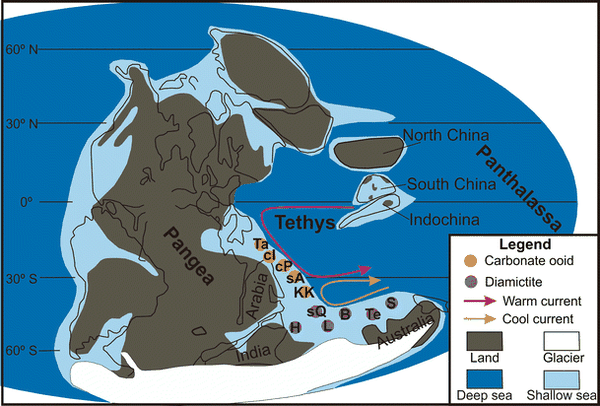
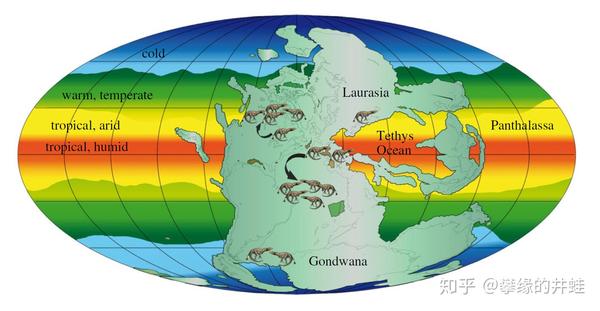
二叠纪早期大陆,冰川,浅海分布,和古特提斯海的洋流走向。今天,浅海大陆架孕育着五光十色的生物礁,冷暖洋流交汇处则形成了许多大型渔场。有理由相信,曾经的古特提斯海也是同样的绚丽繁荣。图片来源字[1]。



石炭纪到二叠纪的海洋生命复原图。古生代晚期的海洋环境稳定平和,就算是三叶虫这样的老古董(参见第二百十五回 三叶兴亡录 10(完结):绝响),和䗴类这样脆弱的单细胞(参见第一百七十四回 Single Cell),都可以保住属于自己的小小生态位。至于更加强势的珊瑚,苔藓虫,腕足动物,棘皮动物,双壳类,腹足类,菊石,硬骨鱼和软骨鱼等等,更是争奇斗艳,大显神通。图片来源自网络。
然而在二叠纪末,所有的这一切:阳光,海流,食物,栖息地和繁殖场——全完了。
峨眉山大火成岩省,和西伯利亚暗色岩,完成了对陆地生态系统的屠戮之后,自然而然地把矛头指向了海洋。
这里补充一个知识点:地幔柱最贴近地表的位置被称为“热点(Hotspot)”。随着板块的漂移,当岩石圈在热点上拖过时,火山就会趁机在相对薄弱的部位露个头,喷发一波,在地图上打出一串火山锥(陆地上)或者岛链(海洋中)。
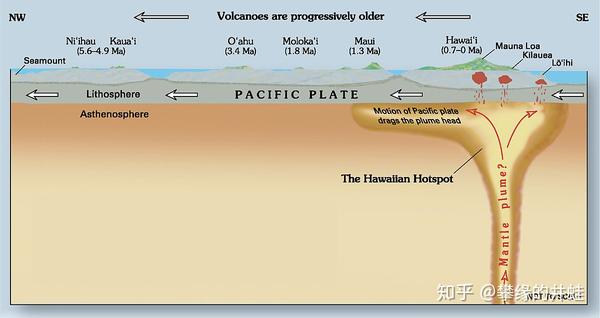
夏威夷岛链(如上图)就是非常典型的热点岛链:活火山坐落在热点之上,正在形成新的岛屿;越靠近热点的岛屿越年轻,越远离热点的岛屿越年长。图片来源自网络。
其实,如果超级地幔柱在海底爆发,反倒不会造成如此规模的生态灾难。以海洋的巨大体量,还有海水的高比热容和高汽化热,完全可以充当冷却器和缓冲器,把破坏控制在有限的范围之内。而且有了海水的阻隔和吸收,巨量的固体烟尘,以及二氧化硫和二氧化碳气体,也不会不加处理地直接排放到大气中,造成不可收拾的后果。
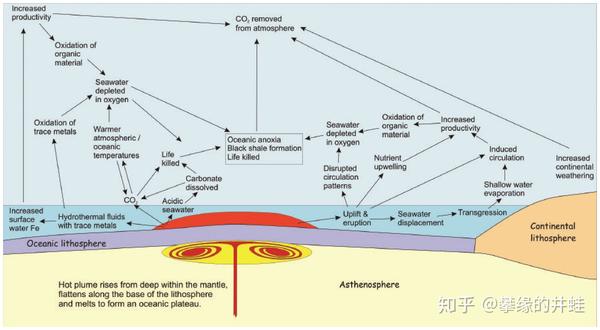
地幔柱穿透海底岩层,形成海底高原(Oceanic plateau)示意图。当然,这个过程也会对气候和环境产生一系列影响(图中的箭头和小字),但不至于到灭顶之灾的地步。图片来源自[2]。
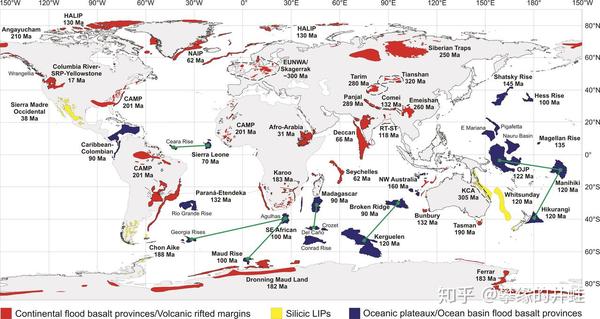
还是这张全球大火成岩省分布图。注意在太平洋和印度洋底部,有几块超大的海底高原(OJP,Manihiki,Hikurangi,Kerguelen),它们全都形成于大约 1.2 亿年前(白垩纪早期),这场地幔柱事件的规模可能不亚于西伯利亚暗色岩,却并没有造成二叠纪末那样恐怖的大灭绝事件。图片来源自[3]。
偏偏在二叠纪末,几个超级热点全都在陆地上连续引爆。如果不是冥冥中有某种意志的话,那就只能说那个时代的生物运气实在太糟糕了。
长达百万年的大规模火山活动,一刻不停地向空气中释放二氧化硫,泛古大陆成为酸雨的重灾区,连绵的硫酸雨杀死了覆盖地表的植被。失去了植物的保护和涵养,再加上酸性雨水的冲刷腐蚀,水土流失变得异常严重。各大江河浊水翻腾,裹挟着巨量的泥土,火山灰,崩解的沙石,还有各种动植物的遗骸和腐殖,源源不断地输送到海洋。
曾经澄澈鲜丽的浅海变得浑浊黯淡。大型藻类和动物体内共生的单细胞藻类被切断了阳光供给,有机物的合成被迫中止,大规模的饥饿随之而来。这些来自陆地的污泥也会覆盖在动物身上,阻碍活动,甚至堵塞呼吸系统,造成窒息和死亡。
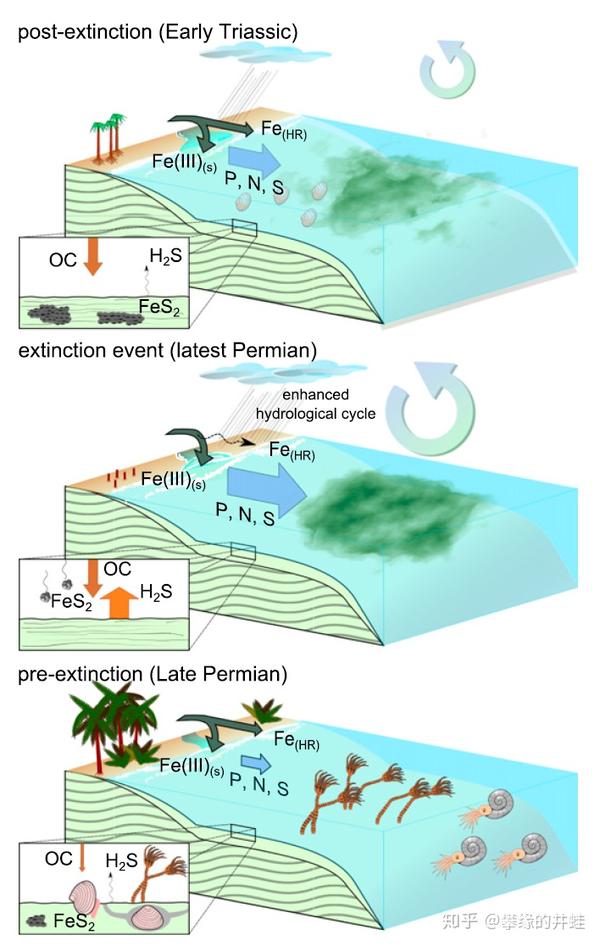
二叠纪末浅海生态系统的遭遇。在古生物代晚期,地球生态系统的物质循环已经非常完善,构成了一个有机的整体。当陆地生态系统遭到严重破坏后,很快超量的污染就会被排入海洋,引发新一轮的生态系统崩溃。图片来源自[4]。
死去的生物遗骸成为各种厌氧细菌的温床,在分解尸体的过程中不断消耗海水中本就不多的溶解氧,造成大面积的海洋缺氧(Oceanic anoxia)。溶解氧几乎耗尽的水层被称为最小含氧带(oxygen-minimum zone,OMZ),由于水流,温度,密度等等波动,最小含氧带不会停留在一个地方,而是会迁移扩散到不同的深度和更广大的范围。它就像海洋中的毒气团,所过之处,尸体狼藉。然后这些尸体又会滋生更多厌氧菌,像滚雪球一样不断扩大。
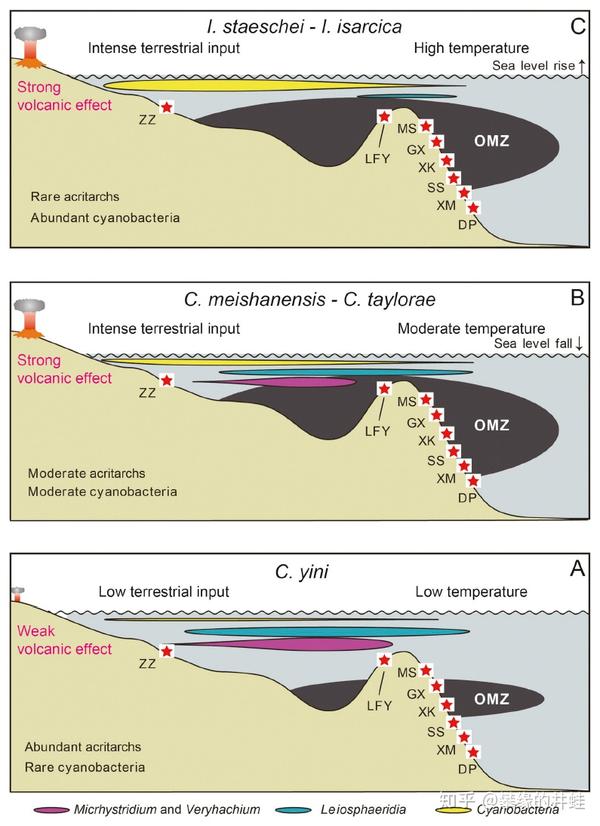
正常情况下,海洋中也是存在最小含氧带的,但影响范围有限(如 A 图)。在二叠纪末大灭绝中,最小含氧带急剧扩张,覆盖了大片浅海区域,卷入其中的绝大多数生物都难逃一劫。图片来源自[5]。
相对封闭的古特提斯海成了污染最严重的地区。四周环绕的陆地和岛屿阻碍了污染物的扩散和稀释,曾经最生机勃勃的乐土,此时变成了散发着氨氮和硫化物臭气的超大蓄污池。
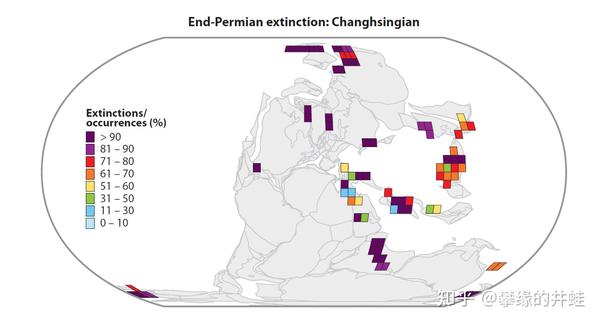
二叠纪末主要生物群物种的灭绝比例统计。环古特提斯海地区的化石发现地最多,说明这里生态环境优越,生物密度高,沉积条件适合化石形成。结果当大灭绝袭来,这里承受的灾难也更沉重。图片来源自[6]。
海洋缺氧给那些固定不动,或者运动能力不强的浅海动物带来了灭顶之灾。古生代最主要的造礁生物,自奥陶纪就繁盛的横板珊瑚目(Tabulate corals)和四射珊瑚目(Rugose corals,参见第六十七回 广厦千万间)彻底消失,一同消失的还有棘皮动物的海蕾纲(参见第二百十八回 寒武纪的余烬:棘皮动物篇(下))。苔藓虫,腕足动物和海百合的种类锐减 90%以上,海绵,腹足纲和双壳纲也都陷入演化史上的低谷。
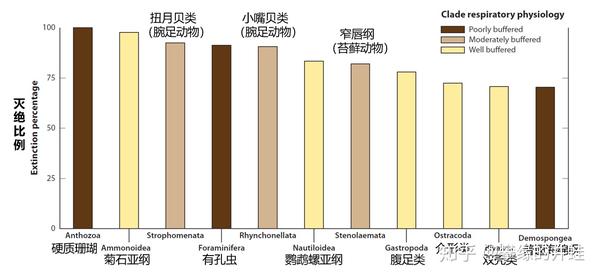
一些海洋无脊椎动物类群在二叠纪末大灭绝中的损失统计。造礁珊瑚(Scleractinian corals)100%灭绝,直到 600 万年后,另一些珊瑚虫才再次演化出制造硬质骨骼的能力。图片来源自[6]。

一些 PTB 附近的腕足动物(1–8),双壳类(9–15)和菊石(16–18)化石,产地:克什米尔(Kashmir)。经此一役,腕足动物和双壳类这对老冤家又一次被拉回同一条起跑线上。图片来源自[7],黑色标尺长度 2 厘米,灰色标尺长度 5 毫米。

云南(1)和贵州(2)发现的晚二叠世䗴类(Fusulinid,参见第一百七十四回 Single Cell)化石。这些像撒在海底的豆子和米粒一样的大型有孔虫类(Larger Benthic Foraminifera,LBF)对污染和缺氧非常敏感,它们的单细胞身体几乎是立刻就融化掉了,只剩下层层叠叠的微小骸骨。要等到新生代,像这么大的有孔虫类才会再一次出现。图片来源自[8] 。
极少数逃过一劫的生物呈现出一个明显的特征:它们的体型远远小于大灭绝发生前的近亲。这种现象被称为小型化效应(Lilliput Effect)。小型化现象很好解释:相对来说,体型大的动物会需要更多的食物,占据更大的生存空间,消耗更多的氧气和能量,生长周期更长,繁殖效率较低,使得它们更容易在大灭绝种被清除出局。
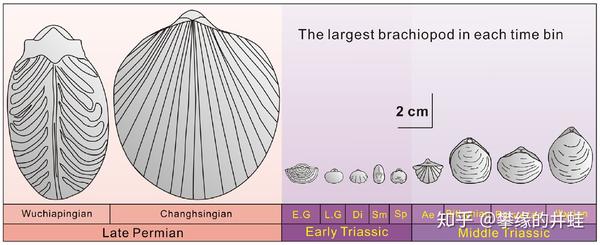
二叠纪晚期和三叠纪早期最大的腕足动物体型对比,这是非常典型的小型化效应的例子。在这之后,双壳类终于爆发出被压制了 3 亿年的演化潜力,在种类,数量和体型上全面超越了腕足动物。图片来源自[9]。
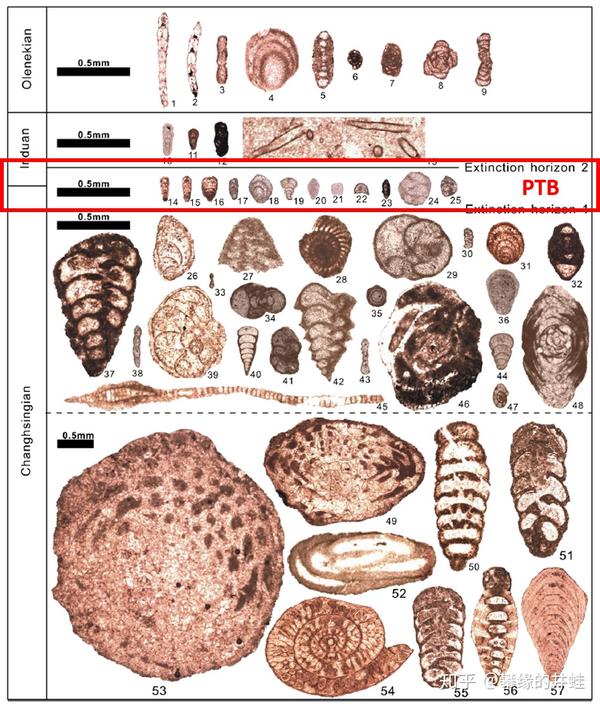
几乎所有大灭绝的幸存者都发生了明显的小型化,甚至连本就微小的单细胞有孔虫类(上图)也不例外。生存的压力煎迫着地球上的所有生命。图片来源自[10]。
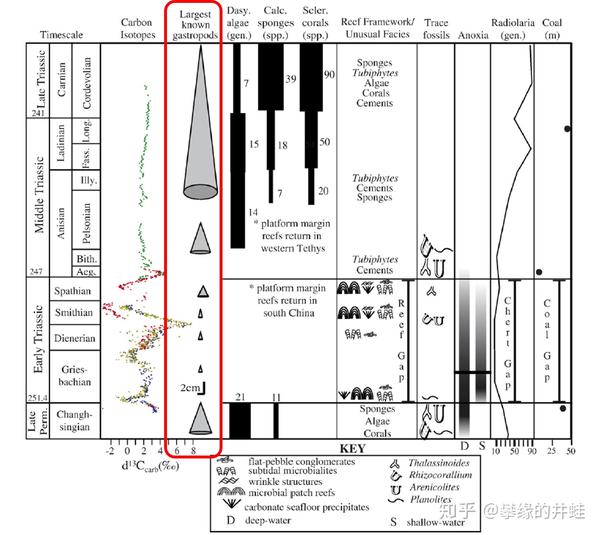
晚二叠世到早三叠世海洋生物化石统计。腹足纲(红框圈出的部分)也出现了明显的小型化现象。腹足纲可以看作具有一定运动能力的底栖杂食动物的代表,和它生态位相近的节肢动物,棘皮动物和小型鱼类也都遇到了同样的生存危机。就是这场浩劫,消灭了最后的三叶虫和板足鲎。图片来源自[11]。
那么,营漂浮和游泳生活,分布在开阔的外洋的生物,是否就能逃过一劫呢?那当然是不可能的。上回介绍过,大灭绝彻底改变了大气组成,二氧化碳浓度飙升,不可避免地溶解到海水中。这引发了全球范围的海洋酸化(Ocean Acidification)。
随着 pH 值的降低,海洋中原本的化学平衡被打破。细胞中各种催化生命反应的酶的活性也受到影响,生活在海洋中上层的浮游生物大批死亡,大洋中的食物网全面崩解。
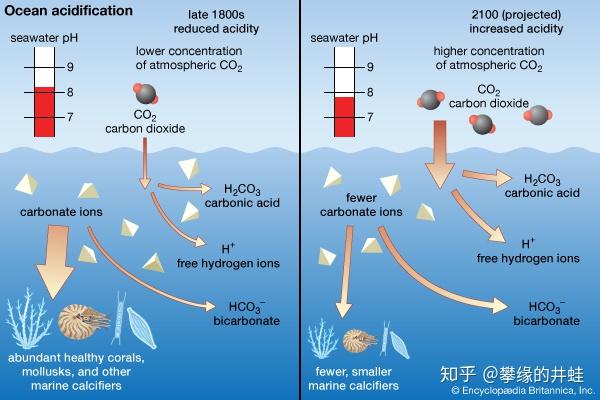
海洋酸化会阻碍固钙生物(marine calcifiers,包括珊瑚,软体动物,有孔虫和放射虫等)制造碳酸钙质的外壳或骨骼,它们同时也是最容易形成化石的生物,会在地层中留下明显的化石空缺——比如二叠纪末这次。图片来源自网络。

人类正在目睹自己排放的二氧化碳造成的海洋酸化。上图中,左侧是一种翼足目海螺的正常外壳,右侧是生活在酸化海水中的同类海螺,外壳变得脆弱和畸形。图片来源自[12]。
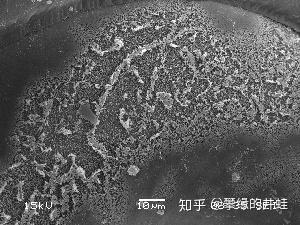
翼足目海螺畸形外壳的扫描电镜照片,可以清晰地看到酸化海水腐蚀的痕迹。图片来源自[12]。
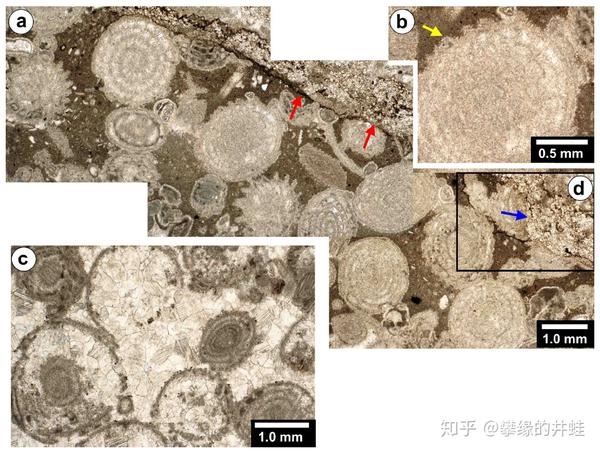
贵州发现的二叠纪晚期石灰岩,上面的有孔虫骨骼发现了被腐蚀的痕迹(黄色和蓝色箭头标示)。这是当时海洋酸化的证据。图片来源自[13]。
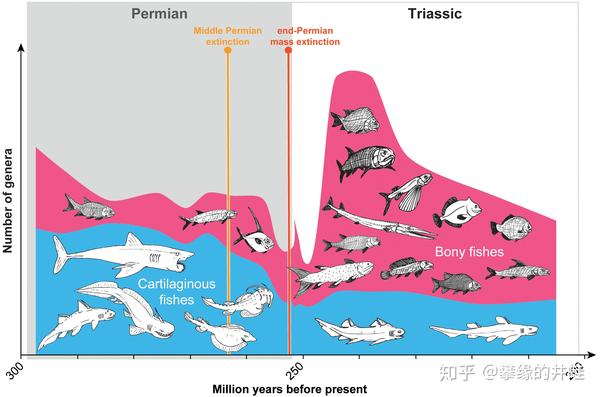
一系列的灾害使得菊石的种类和数量大减,而菊石又是许多大中型鱼类(比如旋齿鲨,参见第二百二十五回 鲛滕记 4:轮)的主要食物。由于二叠纪鱼类化石资料的缺乏,我们并不确切地知道它们的遭遇。能够确定的是:百万年的化石空缺后,中生代的鱼类完全不同于晚古生代。图片来源自[14]。
和海洋缺氧,海洋酸化同时发生的,还有全球变暖。研究者推测,在 PTB 附近,全球气温升高了 8 到 10 摄氏度,到三叠纪早期又上升了 6 到 8 度[15]。随之而来的冰川熔融,海面上升,洋流紊乱,一次又一次地摧折海洋中残存的一丝生气。
PTB 附近的气温分布。当时赤道地区平均气温达到 40 摄氏度左右。和泛古大陆一样,海洋也变成了炙热的蓝色荒漠。图片来源自[15]。
温热的海水更催化了各种微生物的繁殖——它们是这场灾难中唯一的受益者。古老的微生物礁(参见第九回 中太古代 - 叠层岩)再一次兴旺起来。大灭绝几乎把海洋生态系统打回到多细胞生物出现之前的状态。
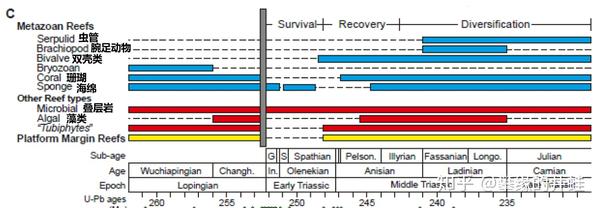
几乎所有的生物礁类型在二叠纪末都出现了中断,只有微生物礁(Microbial reef)连贯始终。这些来自太古宙的生命形式显示出异常强大的韧性。在遥远的未来,很可能只有这些原核生物能陪伴地球走向终结。图片来源自[16]。
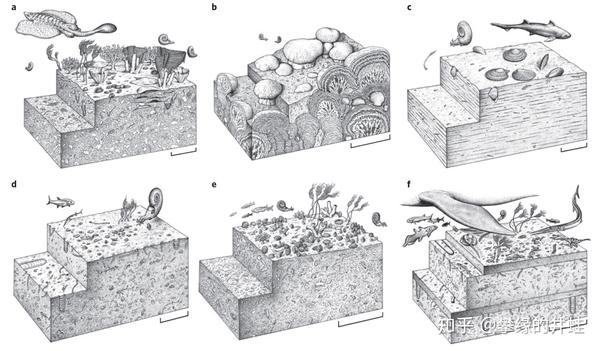
二叠纪晚期(a,大灭绝发生前)到三叠纪早期(b-f)海洋生态系统复原图。b 是大灭绝发生后不久,微生物礁占据统治地位,后生动物几乎绝迹。当生态系统逐渐恢复后,由于动物的取食和破坏,微生物礁再次衰落(c-f)。图片来源自[17],© John Sibbick。
缺氧,酸化和高温的轮番蹂躏,一直持续到三叠纪早期,96%的海洋物种成为了古生代的陪葬。中生代伊始的古特提斯海和泛古洋,污浊,空旷,死寂,除了东一团西一簇的菌胶团,几乎找不到其他生命的痕迹。地球不得不花费数百万年来治疗创伤,准备迎接新的主角登场。
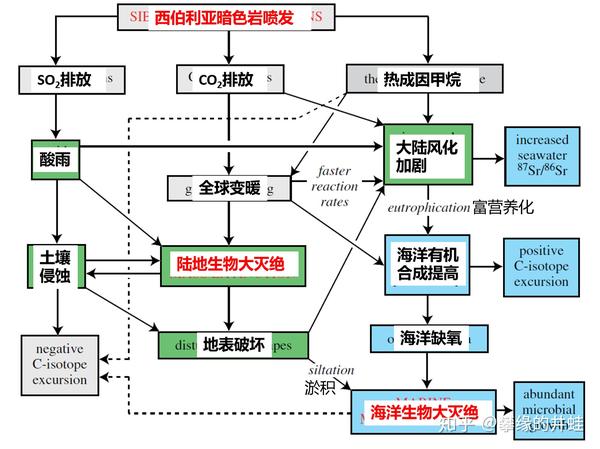
二叠纪末大灭绝的发生过程。如果只是把最上方的“西伯利亚暗色岩喷发”换成“人类活动”,整个模型不但成立,而且是今天正在发生,正在被我们所观察到的。希望人类的智慧和文明可以控制和扭转这个趋势。图片来源自[15]。
地球名片
灭绝事件:二叠纪末大灭绝
发生时间:晚二叠世长兴阶与早三叠世印度阶交界(约 2.52 亿年前),亦有看法将瓜德鲁普统末期大灭绝包括在内
持续时间: 研究者看法不同,普遍认为在 100 万年到 200 万年之间
发生原因:西伯利亚暗色岩事件等一系列超级地幔柱事件
灭绝规模:约 75%陆生物种灭绝,约 96%海洋物种灭绝,全部物种灭绝约 95%
灭绝生物:陆地上:全部锯齿龙类,全部丽齿兽类,全部壳椎类,大部分二齿兽类,大部分兽头类,大部分离片椎类,大部分陆生植物。海洋中:全部三叶虫,板足鲎,棘鱼,四射珊瑚,横板珊瑚,海蕾;90%以上的腕足动物,菊石,海百合;大部分双壳类,腹足类,介形类,牙形石和鱼类。
继起生物:二齿兽类,主龙形类,肋木,硬骨鱼类,海洋爬行动物
参考文献:
[1] Huang, Hao, Jin, Xiaochi, Li, Fei, Permian oolitic carbonates from the Baoshan Block in western Yunnan, China, and their paleoclimatic and paleogeographic significance. International Journal of Earth Sciences, 2017, DOI: 10.1007/s00531-016-1400-6
[2] Andrew C. Kerr, Oceanic LIPs: the kiss of death. ELEMENTS, VOL. 1, PP. 289–292, 2005, DOI: 10.2113/gselements.1.5.289
[3] Scott E. Bryan, Luca Ferrari, Large igneous provinces and silicic large igneous provinces: Progress in our understanding over the last 25 years. GSA Bulletin, 125 (7-8): 1053–1078, https://doi.org/10.1130/B30820.1
[4] Martin Schobben, Alan Stebbins, Abbas Ghaderi, et al., Flourishing ocean drives the end-Permian marine mass extinction. PNAS, vol. 112, no. 33, 10298–10303, 2015
[5] Yong Lei, Jun Shen, Thomas J. Algeo, et al., Phytoplankton (acritarch) community changes during the Permian-Triassic transition in South China. Palaeogeography, Palaeoclimatology, Palaeoecology, https://doi.org/10.1016/j.palaeo.2018.09.033
[6] Jonathan L. Payne, Matthew E. Clapham, End-Permian Mass Extinction in the Oceans: An Ancient
Analog for the Twenty-First Century? Annu. Rev. Earth Planet. Sci., 2012, 40: 89–111, doi: 10.1146/annurev-earth-042711-105329
[7] Yuangeng Huang, Zhong-Qiang Chen, Thomas J. Algeo, et al., Two-stage marine anoxia and biotic response during the Permian–Triassic transition in
Kashmir, northern India: pyrite framboid evidence. Global and Planetary Change, 172 (2019), 124–139
[8] Hao Huang, Xiaochi Jin, Yukun Shi, A Verbeekina assemblage (Permian fusulinid) from the Baoshan Block in western Yunnan, China. Journal of Paleontology, 89, pp 269-280, 2015, doi: 10.1017/jpa.2014.24
[9] Jing Chen, Haijun Song, Weihong He, et al., Size variation of brachiopods from the Late Permian through the Middle Triassic in South China: Evidence for the Lilliput Effect following the Permian-Triassic extinction. Palaeogeography, Palaeoclimatology, Palaeoecology (2018), https://doi.org/10.1016/j.palaeo.2018.07.013
[10] Haijun Song, Jinnan Tong, Z.Q. Chen, Evolutionary dynamics of the Permian–Triassic foraminifer size: Evidence for Lilliput effect in the end-Permian mass extinction and its aftermath. Palaeogeography, Palaeoclimatology, Palaeoecology, 308 (2011), 98–110, doi: 10.1016/j.palaeo.2010.10.036
[11] Andrew H. Knoll, Richard K. Bambach, Jonathan L. Payne, et al., Paleophysiology and end-Permian mass extinction. Earth and Planetary Science Letters, 256 (2007), 295–313
[12] https://www.noaa.gov/noaa-led-researchers-discover-ocean-acidity-dissolving-shells-tiny-snails-us-west-coast
[13] Stephen Kershaw, Sylvie Crasquin, Yue Li, et al., Ocean Acidification and the End-Permian Mass Extinction: To What Extent does Evidence Support Hypothesis? Geosciences, 2012, 2, 221-234, doi: 10.3390/geosciences2040221
[14] C. Romano, M. B. Koot, I. Kogan, et al., Permian-Triassic Osteichthyes (bony fishes): Diversity dynamics and body size evolution. Biological Reviews, 2014, S., 1-44. DOI: 10.1111/brv.12161
[15] Benton MJ., Hyperthermal-driven mass extinctions: killing models during the Permian–Triassic mass Extinction. Phil. Trans. R. Soc., A 376: 20170076, 2018
[16] Rowan C. Martindale, William J. Foster, Felicitász Velledits, The survival, recovery, and diversification of metazoan reef ecosystems following the end-Permian mass extinction event. Palaeogeography, Palaeoclimatology, Palaeoecology, 2017, doi: 10.1016/j.palaeo.2017.08.014
[17] Zhong-Qiang Chen, Michael J. Benton, The timing and pattern of biotic recovery following the end-Permian mass extinction. NATURE GEOSCIENCE, DOI: 10.1038/NGEO1475

 微信扫一扫
微信扫一扫