这个问题挺有趣的,没人答可能是比较复杂吧。
先讲一个问题,天然碱式碳酸铜有没有固定的化学组成?天然的碱式碳酸铜有两种,亮绿色的孔雀石(Malachite):Cu₂(OH)₂CO₃,下图左,蓝色的蓝铜矿(Azurite,古称石青):Cu₃(CO₃)₂(OH)₂,下图右。这两个化合物组成很固定,而且可以相互转化。人工合成孔雀石的方法是把二氧化碳通入氢氧化铜悬浊液。

而直接把碳酸盐和铜盐混合会得到比例不固定的碱式碳酸铜,之后和碳酸氢盐混合陈化会得到比例固定的孔雀石(还真有化学老师试过类似的实验[1])。金属和碳酸钠反应直接得到碱式碳酸盐的这个现象很常见,
等和碳酸钠反应都会先形成碱式碳酸盐,但是它们和碳酸氢盐混合陈化后可以得到碳酸盐,铜离子则不会。
由上可知,1)碱式碳酸铜是热力学稳定的。2)稳定性和晶体结构相关。
(碱式碳酸铜会出现在教材上和普鲁斯特的“定比定律”有关,普鲁斯特指出人工合成的孔雀石和天然的孔雀石成分相同,对这一发现的解释推动了道尔顿提出新原子论,传统的教材中对这事有记载。)
只说热力学似乎没有正面回答问题,结构上讨论的话,氢氧化铜不稳定和其他金属氢氧化物类似,很好理解,而从晶体角度分析碱式碳酸铜的反应活性我也不擅长。希望能有大佬给个更好的思路。
就只说其中一个问题吧,为什么碳酸铜不稳定?
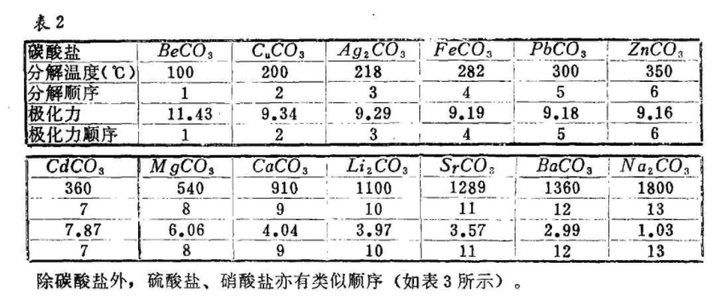
碳酸铜有多不稳定呢?至今还没有制备出纯净的碳酸铜,原因是总会有部分分解成 CuO 和 CO₂,学无机的时候,我的理解是碳酸根因为对称性的问题容易被极化,当遇到的阳离子又小电荷又多的话容易被极化而削弱 C-O 键,即氧原子首鼠两端,不知道听谁的好。

上面这个解释非常“应试”,而且有些硬凑的嫌疑,但还是有证据的。
- 碳酸钙中三个 C-O 等长,129.4 pm。
- 碱式碳酸铜中三个 C-O 键:124 pm,127 pm,130pm。
- 碳酸氢钠中三个 C-O 键:126.3 pm,126.4 pm,134.6 pm,最长的是 C-OH 键。
也有文献说直接和“极化力”相关的[2],当然这文献里碳酸铜的分解温度也不知道怎么来的。而且氢氧化铍溶液在加压的情况下和二氧化碳反应可以得到四水合碳酸铍。
另一个解释则是 Atkins 无机上的解释(《无机化学丛书》上也用的这个解释)。
他的出发点是 MCO₃ → MO + CO₂↑ 这个反应自由能问题,讨论了晶格焓
(点阵焓)等因素对系列反应的焓变的影响,中间的图是说为什么“瘦”的阳离子和阳离子的亲和度更高,不喜欢“胖”的碳酸根。
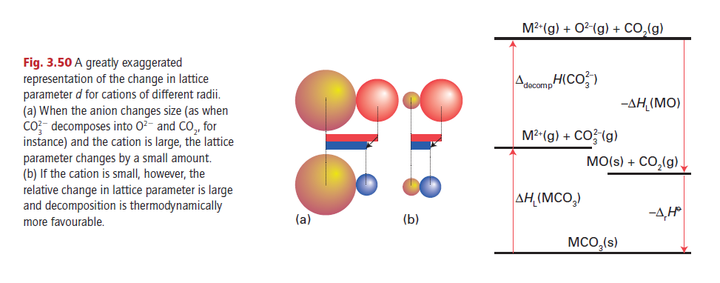
正经一些说就是“金属离子半径越小,碳酸盐不稳定”这一点可从反应的产物和生成物的离子晶体结构上理解,碳酸盐分解反应的熵变值都近似相等,因此自由能的值主要由反应热ΔH 决定,而反应的ΔH 则与产物(MO)和反应物(MCO₃)的晶格焓相关(上图右),因为氧离子离子的半径比碳酸根要小,所以随着离子半径增大,MO 点阵能减小值较 MCO₃点阵能减小值多,反应不易进行,因而使自由能下降,也就是说,金属离子半径小的碳酸盐,由于产物 MO 较稳定,分解容易进行。
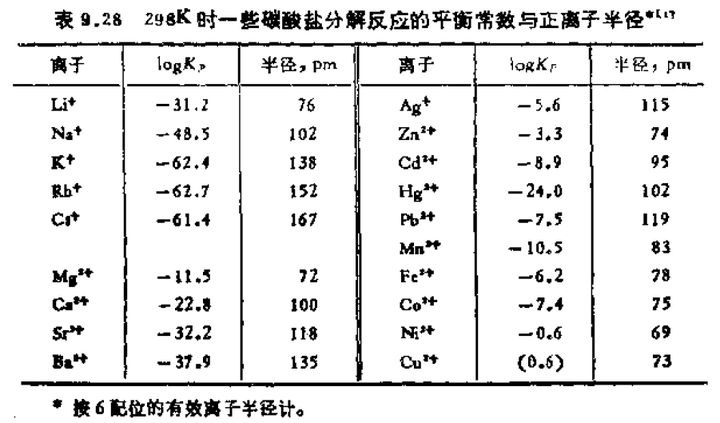
上图的 logKp 是反应的平衡常数,因为两个固体一个气体,就等于反应平衡时产生二氧化碳的分压。
能看出无论是那种解释,都说明一点,碳酸铜不稳定是因为半径小电荷多,金属离子会和碳酸根竞争氧原子。但我觉得碳酸铜这么不稳定还和自身的其他性质相关,比如 Jahn—Teller 效应,只看半径的话,镁和镍离子都更小。
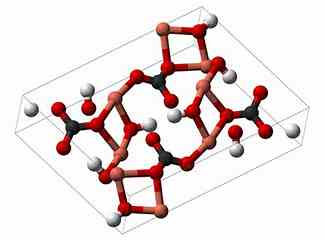
黑色:C;白色:H;红色:O;粉色:Cu。图片来自网络[3][4]。
所以纯的氢氧化铜有碱性,会和二氧化碳反应,而且容易脱水;纯的碳酸铜由于铜离子的极化能力或半径容易分解;碱式碳酸铜中氢氧根削弱了铜离子的极化力,同时阻止了脱水反应,因此稳定。

 微信扫一扫
微信扫一扫