这个问题出在认为“有氢键就不会疏水”,还有逆否命题,“疏水就不会有氢键”。
现实中的问题,往往是多因多果的,没有教材上讲的那么简单。一种物质是否亲水,是否和水互溶是一个非常复杂的问题,氢键只是其中一个要素而已。
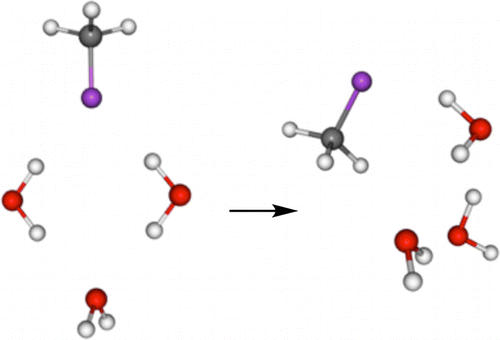
比如下面这篇文章[1]就指出,最简单的有机氟化物——氟甲烷在气相中可以和水形成氢键,却不溶于水(三氟甲烷溶解度就大了)。原因是氟甲烷和水形成的氢键不能降低互溶体系的能量。详细点的解释是,虽然理论计算指出氟甲烷形成的氢键强度几乎与水相同,但它必须作为双氢键受体与这些簇结合,这导致氟甲烷不能与水分子形成低能状环状的 2D 氢键网络,限制了它在水中的溶解度。
而含氟材料,比如含氟高分子疏水的原因就更复杂了。下面仅是可能的原因。
全氟化合物溶解氧气的原理是什么?
之前的一个回答提过,全氟烷烃不仅疏水,其他化合物也疏,甚至自己都疏,而且因为偶极相互抵消,极性很低,因此全氟化合物被称为“Gas-Like Liquids”(像气体的液体)。
这些和氟的电负性大和原子半径小相关。氟原子的范德华半径只比氢原子大一些,比其它元素的原子半径小,而且由于相邻氟原子的相互排斥,使氟原子不在同一平面内,主链中氟原子沿碳链作螺旋分布,把碳碳链严密地包裹住了,这样使得原子很难嵌入。而且氟碳原子的共用电子对大大偏向氟原子,形成一层负电荷保护。[2]下图是解释全氟烷烃溶解氧时用的示意图,体现了“螺旋状”,“分子间离得远”的特点。
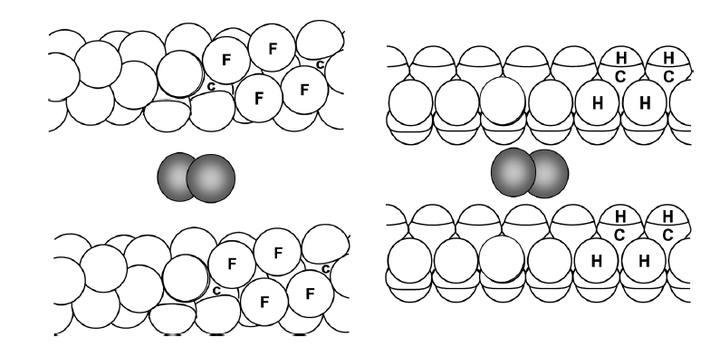
上面这些性质的另一个具体表现就是含氟材料表面能很低,疏水疏油。而且氟甲烷的例子也说明了这种体系即使能形成氢键,也不会降低体系的能量。
前几年一个其他院系的课题组来化院做实验的时讨论过类似的问题。她老板看到 PDVF 加压后可以极化,突发奇想,提出了一个天马行空的方案——PVDF 滤膜电场加压后“一面带正电一面带负电”,因此可以吸附铵离子和有机阳离子(极化 + 氢键),起到类似离子交换树脂的效果。我能说这个故事是因为半年后她用实验证明这个想法不可行。
有时候过于简单的模型会带来误解。
也没有嘲讽他们的意思,因为术业有专攻,他们基本没怎么学大学化学,不过他们又经常要做色谱之类的实验。有一次他们院的同学问过我一个问题“甲氰能溶于水是因为结构里有氨基吗?”。
我当时想了一个例子,向他们解释“溶解性的原因很复杂”,“存在氢键和水溶性不是特别相关”——如果认为丙酮和水互溶是因为羰基可以和水形成氢键的话,乙酸乙酯怎么就不互溶呢?
还要强调一下这里的含氟材料疏水指的是全氟烷烃这类化合物,也有含氟材料亲水的例子。

 微信扫一扫
微信扫一扫