核外电子排布是非常有意思的。在开始的时候,人类发现电子之后不知道电子在原子里面怎么样存在。于是人们提出了各种各样的模型来解释。比较出名的就是 J. J. 汤姆逊(电子的发现者)提出的葡萄干面包模型:电子像是葡萄干嵌在面包里一样嵌在原子里。但是这个模型被一个著名的实验否决了。在做完α粒子散射实验后,卢瑟福提出了新的原子模型。他认为原子核在中心固定,而电子在原子核周围转动。但按照经典力学,电子一定会坠入原子核中。也就是说,这个模型是不稳定的,原子不可以稳定存在。为了解决这个问题,玻尔提出了颠覆性的模型。原子核就像太阳,电子就像行星一样在分立的轨道上转。而这些轨道是固定的,电子不可能出现在两个轨道中间的地方。这便是不连续的行星模型。
当然这个模型并不完全正确,但却是人类踏入量子世界的第一步。
好了扯完了历史,咱们来扯一扯核外电子排布。咱们在初中化学学过,而且还画过原子结构示意图是吧。你看到电子分层存在,这个层便是“能层”(有些地方叫能级,但我将会采用《无机化学 第四版》的叫法)。能层就是你看到的一圈一圈的东西,每一圈就是一个能层。之所以叫能层是因为电子能量不同,而且离原子核距离也不同,就好像一层一层的。
能层里面还有能级(有的书叫亚层)。就好像一层一层的抽屉里有小格子一样,一个能层里有不同的能级。你看到的 s、p 那样的小写字母表示的就是能级。那我们要表示一个能级,就要先说出它在哪个能层,然后再具体说出它是那个能层的哪个能级。举个 ,能级的命名就像是 2s,4f 这样的。
然后能级里面有轨道(有的书上叫“轨函”,但是我从未见过这样的书)。现在我们终于可以锁定一个电子了吗?也就是说,给定一个能层、能级、轨道,电子就唯一确定下来了吗?还差一点。一个轨道上能装俩电子,那到底是哪个电子呢?
随着电子的自旋被发现,人们发现了确定一个电子最后的一个需要的参数:自旋。自此我们终于可以确定一个原子里的电子了。比如我们可以说,在第二个能层里面的 p 能级的 -1 轨道上上旋(自旋向上)的电子,它就是唯一确定的了。
但是这样还是太麻烦,我们不如用数字来表示电子好了。
描述电子的第一个数是它所在的能层,用数字 n 来表示。n 就是主量子数。n = 1 的电子就在你画的原子结构示意图上最靠近原子核的那一层里。这里你可能发现了,描述电子的数叫量子数。
为什么叫量子数呢?因为量子数是不连续的,前三个量子数只能取整数,最后一个量子数可以是半整数,所谓“量子的”就是“不连续的”。
第二个量子数就是表示能级的量子数,名曰“角量子数”,字母是 l(小写的 L)。这个 l 并不是可以随意取值的。它的取值范围是 l = 0, 1, 2, ..., n - 1。也就是说,对于第二能层(主量子数为 2),l 只能取 0 和 1。换句话说,第一个能层只有一个能级,第二个能层就有两个能级,第三层就可以装三个能级了。能级是有名字的,l = 0 叫 s 能级,l = 1 叫 p 能级,l = 2 叫 d 能级,l = 3 叫 f 能级,再往后就按字母表顺序 g、h、i、j……等等,但是人类目前还没有发现那些能级里面有电子的。最后总结一下,第一能层(主量子数 n 为 1)有一个能级,是 l = 0 的 s 能级;第二能层(主量子数 n 为 2)有两个能级,分别是 l = 0 的 s 能级和 l = 1 的 p 能级,以此类推。
第三个量子数便是表示这个电子在哪个轨道上的量子数,名字叫“磁量子数”,字母是 m。它的取值是 m = 0, ±1, ±2..., ±l(角量子数 l,小写的 L)。也就是说,s 能级只有 1 个轨道,因为 l = 0,所以 m 只能取一个值 0。p 能级有三个轨道,m 分别取 0, -1, +1,以此类推。
最后一个量子数是自旋量子数,符号是
。对于电子来说,它只有两个取值,分别是±1/2,也就是自旋向上的电子和自旋向下的电子,简称上旋和下旋。这意味着,一个轨道里只能容纳两个电子,因为自旋量子数没有第三个值可以取了。
现在我们来看一个例子。氧原子的核外电子排布是怎么弄的呢?
首先氧原子有 8 个电子,原子结构示意图是 2,6。为什么是 2,6 不是 3,5 呢?因为第一能层只有 s 能级,再看 s 能级只能有一个轨道,而一个轨道最多能装俩电子,所以第一能层只能装俩电子。第二能层最多装 8 个电子对吧。怎么来的?就是第二能层有两个能级,一个 s 一个 p,s 能级只有一个轨道俩电子,而 p 能级有仨轨道 6 个电子,加起来就是 8 个。
所以现在咱们写出氧原子的核外电子排布,就是
。拆开了看,
代表第一能层,s 能级有两个电子。
代表第二能层 s 能级有俩电子。还剩下几个电子?已经填了 4 个,所以还剩下四个。p 能级最多能装几个?6 个,所以全都填到 2p 能级就好了,也就是
。
电子填入能级的目标是使整个原子能量越低越好。现在有两个能级,x 能级和 y 能级,如果 x 能级能量比 y 能级低,那么电子就会首先填入 x 能级。因为能量越低越稳定。当然 x 和 y 表示随便两个能级,并没有字母是 x 的能级和字母是 y 的能级。
要是对于更加复杂的原子,比如 26 号元素铁
会发生能级交错现象。你看 3d 轨道(能装 5 × 2 = 10 个电子)只装了 6 个电子,没满,这是因为 4s 轨道的能量反而要低于 3d 轨道,所以会先去填 4s 轨道,填满之后再填 3d 轨道。所以铁之后的 27 号元素钴就是
,区别仅在于 3d 轨道。
那能级交错怎么记呢?这里有一张图
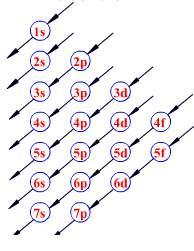
至于“半满规则”和“全满规则”最好的例子就是 24 号元素铬和 29 号元素铜。咱们先说铬,
,这里没有先填满能量更低的 4s 轨道,而是先把 4s 填了一个电子,然后就去填 3d 了,这是因为 3d 能级半满的时候更稳定,你看 3d 最多装 10 个,现在装了 5 个刚好半满,这个时候更稳定。同理,铜的情况类似。
,3d 全满更稳定。
其实化学很好玩,但是学习一定要看兴趣。学习能学好,当且仅当有兴趣。

 微信扫一扫
微信扫一扫